El día que entendí por qué la ley de Boyle en el buceo es el secreto para ser un buceador preciso.
Te cuento algo que me pasó, algo que todos hemos vivido en algún momento, pero sin darnos cuenta del todo: uno de esos días en los que todo parecía perfecto, pero… ¡por poco la lío!
Era una inmersión en aguas tranquilas, con visibilidad espectacular y todo marchando sobre ruedas.
De repente, me di cuenta de que mi flotabilidad no estaba bien, algo no cuadraba.
Lo corregí de inmediato, pero al ascender, sentí que no tenía control total sobre mi velocidad y me asusté.
¿Sabes lo que había pasado?
No había tenido en cuenta cómo la presión y el volumen de aire se comportan bajo el agua.
Ahí fue cuando me di cuenta de que no se trata solo de bucear, sino de entender cómo funciona el agua a tu alrededor.
¿Y qué tiene que ver todo esto con la ley de Boyle y el buceo? Pues mucho.
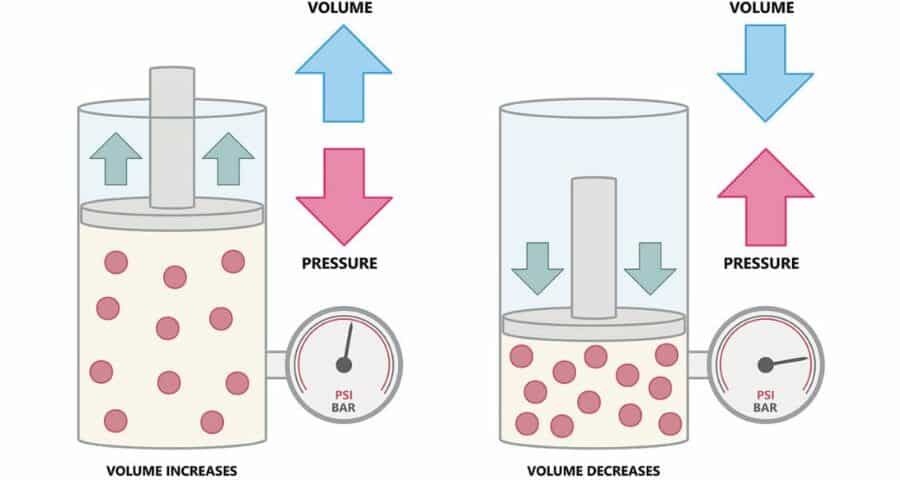
Es la clave para entender cómo la presión cambia el volumen del aire, el aire que hay en tu chaleco, en tu neopreno e incluso el de tus pulmones.
Por tanto, también es clave para manejar tu flotabilidad de manera más precisa. El buceo fino, que le llamo yo. Y para mejorar el consumo de aire.
Porque si hay algo que aprendes con el tiempo es que entender los principios de la física no solo es útil, es el ABC para un buceo más avanzado y eficiente.
Si alguna vez te has preguntado:
- ¿Por qué tu chaleco se infla como un globo cuando asciendes, aunque tú no le hay metido aire?
- ¿Por qué sientes que tu consumo de aire se dispara en profundidad?
- ¿O por qué te dijo tu instructor que ascendieras despacio?
Entonces, amigo, necesitas ver al buceo según la ley de Boyle. Quédate tranquilo, no vamos a entrar en fórmulas de científico loco (aunque si te gustan, también las tenemos).
Ley de Boyle es solo una de las leyes que entran en juego cuando estás bajo el agua.
Estas leyes son como los mandamientos del buceo.
- Boyle: La presión baja, el aire se expande. La presión sube, el aire se comprime. Fácil, ¿no?
- Charles, Henry y compañía: Cada uno tiene su truco, y todos son igual de importantes
¿Quieres aprender a controlar tu flotabilidad como un maestro Jedi? ¿Evitar accidentes y controlar tu consumo de aire? Sigue leyendo, que aquí te cuento cómo aplicar la Ley de Boyle al buceo.